Зонная теория
*
Представим себе достаточно большую группу атомов. Практически это значит, представим себе любой кусочек любого материала, не состоящего из молекул - металла, керамики, стекла, некоторых неметаллов (графита, кремния). Для сравнения, одна крохотная железная опилка размером 1 х 0.5 х 0.5 миллиметра содержит порядка 2·1016 атомов, то есть очень большую группу. Попробуем понять, что будет происходить с электронными орбиталями атомов в такой большой группе.
Экспериментальные данные показывают, что в металлах атомы находятся вплотную друг к другу. В керамических и неметаллических материалах часть атомов также плотно прижаты друг к другу, часть расположены с некоторыми промежутками. В любом случае, в любом образце любого из этих материалов имеется очень большое количество атомов, плотно прижатых друг к другу, так что их орбитали частично перекрываются.
Мы уже знаем, что если орбитали двух атомов перекрываются, энергетический промежуток между соседними орбиталями уменьшается. А что происходит, если перекрываются орбитали не двух, а большего числа атомов? Собственно, нас интересуют даже не все орбитали, а всего две, имеющие особую важность. Первая из этих орбиталей носит название HOMO (Highest Occupied Molecular Orbital - Самая Высокая занятая Молекулярная Орбиталь), а вторая - LUMO (Lowest Unoccupied Molecular Orbital - Самая Низкая Незанятая Молекулярная Орбиталь). Особая важность этих двух орбиталей связана с электронными переходами. Если электрону любым способом сообщить энергию, то он перейдет в возбужденное состояние, при этом в возбужденном состоянии электрон не может находиться на своей обычной орбитали, он "обязан" перейти на более высокую орбиталь, соответствующую его повышенной энергии. На этой более высокой орбитали электрон пребывает некоторое короткое время (очень типично время жизни возбужденного состояния 10-8 сек, хотя бывает и меньше, и больше), а потом испускает избыточную энергию и возвращается в основное состояние на свою "родную" орбиталь. Электронные переходы из основного состояния в возбужденное и обратно происходят все время и именно с ними связаны важнейшие процессы: образование и изменение цвета, поглощение, отражение и рассеяние света, радиоволн и многих других видов излучения, многие химические реакции. Примерно 98% электронных переходов - это переходы между орбиталями HOMO (основное состояние) и LUMO (возбужденное состояние). От энергетической разности между этими двумя орбиталями зависят многие свойства вещества.
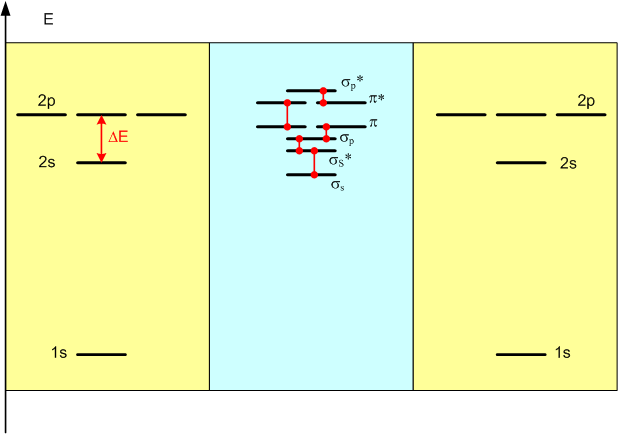
Вернемся к перекрыванию орбиталей. Если перекрываются орбитали двух атомов, то расстояние HOMO-LUMO, обозначенное на рисунке ΔЕ, уменьшается в результате расщепления атомных подуровней на более часто расположенные молекулярные подуровни:
Если в перекрывании участвуют не два, а большее число атомов, произойдет примерно то же самое: атомные подуровни расщепятся на более часто расположенные групповые подуровни. Энергия этого расщепления достаточно невелика, поэтому расщепившиеся "потомки" атомного подуровня не расходятся очень далеко. Для каждой пары бывших атомных орбиталей образуются две новые орбитали, причем одна из них имеет немножко большую энергию, а вторая - немножко меньшую. В результате в относительно небольшом энергетическом промежутке оказывается очень большое количество электронных уровней:
Как можно видеть, процесс расщепления атомных электронных подуровней при перекрывании орбиталей большого количества атомов приводит к двум последствиям. Во-первых, энергетические расстояния между подуровнями-"потомками" орбитали HOMO и орбитали LUMO резко уменьшаются и для достаточно большого количества атомов подуровни переходят друг в друга непрерывно. В таком случае не имеет смысла продолжать именовать их квантовыми подуровнями, поскольку для них потеряло смысл само понятие квантования: квантование - это изменение чего-то порциями, а не непрерывно. Вместо группы подуровней лучше использовать понятие зоны (в некоторых русских учебниках предпочитают более точный перевод английского band - "полоса", но по большей части говорят все-таки о зонах). Во-вторых, хотя между зонами существует разница энергии, она все-таки меньше, чем для атомных орбиталей.
Замечание: А почему атомные подуровни обязательно должны расщепляться? Разве нельзя представить себе ситуацию, когда несколько подуровней (или все подуровни) будут иметь одинаковую энергию?
- Нет, это запрещено одним из самых главных законов квантовой механики - принципом Паули. Не вдаваясь далеко в теорию, скажем лишь, что принцип Паули требует, чтобы в пределах одной квантовой системы не было двух или более электронов с одинаковым набором квантовых чисел. Любые два электрона в одной системе должны отличаться хотя бы чем-то. Один из способов достичь этого различия - расщепление энергетических уровней, которые могли иметь одинаковую энергию в двух отдельно существующих атомах, но, объединившись, попали в одну квантовую систему.
С практической точки зрения, образование зон означает, что электроны могут свободно перемещаться внутри каждой зоны, но для перехода из одной зоны в другую им требуется дополнительная энергия. Зона, которая образовалась из атомных орбиталей HOMO, называется валентной зоной (название связано с тем, что в химии внешние электроны атома принято именовать валентными электронами), а зона, образовавшаяся из орбиталей LUMO, называется зоной проводимости.
- Subscribe
- Блог пользователя lugovsa
- Войдите, чтобы оставлять комментарии
Новые записи в блогах
- Как производятся памятники из гранита
- Фильм «Джон Картер» - жизнь на Марсе есть
- Театр-Музей Сальвадора Дали и замок Пуболь
- Игровой автомат Golden Games в казино Эльдорадо
- SlotV с небывалой отдачей
- Шоп туры в Италию
- Пляжный отдых в Греции и Испании
- Заработок без вложений - как поднять денег на играх.
- ТОП достопримечательностей Берлина
- Рокс-клуб, которому можно доверять




Новые комментарии